Методы диагностики лейкозов. Лабораторная диагностика острых лейкозов. FAB-классификация. Лабораторные критерии стадий течения острых лейкозов Исследования, подтверждающие диагноз
Лейкоз КРС - хроническая инфекционная болезнь опухолевой природы, основной признак которой - злокачественное разрастание клеток кроветворных органов с нарушением их созревания, благодаря чему происходит диффузная инфильтрация органов этими клетками или появляются опухоли.
Лейкозы животных диагностируют почти во всех странах мира. Наиболее широко они распространены в США, ряде стран центральной Европы, Дании, Швеции и странах ближнего Востока.
В нашей стране возникновение лейкоза связано с завозом племенного скота в 1940, 1945 – 1947 гᴦ. из Германии в хозяйства Западной Сибири, Московской, Ленинградской, Калининградской областей, а также Украины, Латвии и Литвы. В дальнейшем лейкоз распространился в Таджикистан, Псковскую, Новгородскую области.
В естественных условиях ВЛКРС распространен среди КРС, овец, зебу и буйволов.
Вирус лейкоза КРС (ВЛКРС) относится к семейству Retroviridae, роду ретровирусов лейкоза КРС и Т-клеточного лейкоза человека. ВЛКРС обладает выраженной антигенной активностью и индуцирует синтез ВНА и КСА. ГА свойства. ВЛКРС агглютинирует только эритроциты мышей
Диагноз на лейкоз ставят на основании эпизоотологических данных, клинических признаков, патологоанатомических изменений и результатов лабораторных исследований, которые включают гематологические и гистологические, а также серологические исследования.
Основные характеристики некоторых ретровирусов
Все формы лейкоза характеризуются увеличением в различной степени лимфоузлов. При лимфолейкозе они увеличены равномерно, не сращены с окружающими тканями, капсула снимается легко, на разрезе узлы серо-белого цвета͵ сочные и саловидные. Лимфоузлы при лимфогранулематозе, лимфосаркоме и гистиоцитарной саркоме бугристые, капсула сращена с паренхимой, на разрезе часто обнаруживают кровоизлияния и некрозы; в органах брюшной, тазовой полостей, на серозных оболочках отмечают опухолевые разрастания узлов в виде конгломератов серо-белого, желто-серого цвета. Селезенка при лимфоидном и миелоидном лейкозах увеличена. При первых 2-х формах она буро-красного цвета с четко выраженной красной и белой пульпой за счёт гиперплазии фолликулов. В более поздней стадии болезни граница между белой и красной пульпой стерта. При миелоидном лейкозе селезенка красно-малинового цвета͵ фолликулы плохо заметны, а в отдельных участках отсутствуют, ткань рыхлой консистенции с кровоизлияниями. При лимфоретикулосаркоме селезенка не увеличена. При всех формах лейкоза отмечают очаговые или диффузные разрастания серо-белого или серо-розового цвета в печени, почках, толще сердечной мышцы, органах пищеварения, матке, скелетных мышцах, диафрагме и других органах.
Взятие и подготовка материала . Для гематологического исследования кровь берут из времной вены в пробирки с антикоагулянтом - 10 %-ном р-ром динатриевой соли этилендиаминтетрауксусной кислоты (ЭДТА, трилон Б) из расчета 0,02 мл р-ра на 1 мл крови. Не разрешается брать кровь от животных за 15 дней до отела и 15 дней после него. Важно заметить, что для серологического исследования кровь берут от животных в возрасте 6 мес и старше. В лабораторию в термосе со льдом направляют 5-6 мл сыворотки. Для гистологического исследования кусочки пораженных органов (селезенки, лимфоузлов, грудной кости, печени, почек, легких, сердца и правого ушка сердечной мышцы, стенки сычуга, матки и скелетных мышц) посылают в свежем виде в термосе со льдом или в 10%-ном р-ре формалина.
В гематологии существует понятие о гемобластозах - опухолях, ис-ходящих из кроветворной ткани. Гемобластозы включают лейкозы и гемато-саркомы. Лейкозы - это гемобластозы с первичным опухолевым поражением костного мозга. Гематосаркомы - формы с первичным местным опухолевым ростом, вне костного мозга, это солидные опухоли, состоящие из бласт-ных клеток кроветворной ткани.
Лейкоз - это системное заболевание кроветворной ткани, возникаю-щее из кроветворных клеток и обязательно поражающее костный мозг. В настоящее время опухолевая природа лейкозов не вызывает сомнения, и для большинства лейкозов установлена их клоновая природа. Выявлено, что все опухолевые клетки представляют собой клон, то-есть потомство одной изменённой клетки, которое затем распространилось и метастазиро-вало по всей кроветворной системе. Источником опухолевого роста явля-ется ближайшее потомство (клон) родоначальной - стволовой клетки кроветворения. Способность к метастазированию определяет системный ха-рактер процесса, причём основным местом распространения этих опухолвых клеток является костный мозг вследствие чего вытесняются клетки нор-мального кроветворения.
Этиология лейкозов остаётся невясненной. Как пишет А.И.Воробьёв: "Поаытки найти какую-то одну причину или группу однотипных причин опу-холей человека по своей бедности могут конкурировать разве что с поис-ками Атлантиды". Для отдельных лейкозов уже найдены некоторые факторы, способствующие раскрытию их этиологии. Так, отрыв длинного плеча хро-мосомы из 22 пары и перенос этого участка на одну из больших хромосом 9 пары встречаются почти во всех клетках костного мозга у больных хро-ническим миелолейкозом. Патологическая хромосома из 22 пары с укоро-ченным длинным плечом названа филадельфийской по имени города, где она была открыта в 1959 году Ноуэлом и Хангерфордом. Подобные транслокации хромосом происходят, как правило, под воздействием ионизирующей радиа-ции, так что эти факты подтверждают мутационную природу (чаще всего радиационную) хронического миелолейкоза. После взрыва ядерной бомбы в Японии случаи хронического миелолейкоза и острого лейкоза встречаются в 7 раз чаще, чем в других странах.
Хромосомные нарушения при остром лейкозе носят характер анеуплои-дии - изменения числа хромосом в опухолевой клетке, а не структуры, как при хроническом миелолейкозе. Своеобразная форма острого лейкоза, встречающегося главным образом в Африке,- лимфома Беркитта, обнаружи-вает эпидемические вспышки, дающие основание думать о её вирусной при-роде. Таким образом, в развитии острого лейкоза имеют место разные причины: ионизирующая радиация, генетические нарушения, не исключает-ся роль вирусов.
Хронический лимфолейкоз не обнаруживает зависимости от воздейс-твия мутагенных факторов, включая и ионизирующую радиацию, но имеет отчётливую связь с этническими особенностями. Хронический лимфолейкоз редко диагностируется у некоторых племён и народов.
В настоящее время при отсутствии этиотропной терапии лейкозов осуществляется патогенетическая их терапия, которая позволяет в неко-торых случаях говорить об излечении больных некоторыми видами лейко-зов. Более чем 3-5-летние наблюдения за больными острым лимфобластным лейкозом детьми, находящимися в состоянии полной ремиссии, показывает, что существует принципиальная возможность ликвидации опухолевых клеток даже при их широком распространении по кроветворной системе.
У человека красный костный мозг содержится во всех трубчатых кос-тях, черепе, рёбрах, грудине, ключице, лопатке, позвоночнике, костях таза. Имеются 2 типа клеток в костном мозге: ретикулярная строма и паренхима. Кроветворение - это серия клеточных дифференцировок, приво-дящая к возникновению зрелых клеток периферической крови.
Современная схема кроветворения. Современные представления о кро-ветворении были заложены в 20-е годы А.А.Максимовым. В нашей стране наиболее распространённой схемой кроветворения была схема И.А.Кассирс-кого и Г.А.Алексеева. Однако, в этой схеме самой гипотетической была её верхняя часть, то-есть клетка - родоначальница кроветворения. Ис-пользуемая в настощее время схема кроветворения была предложена
И.Л.Чертковым и А.И.Воробьёвым в 1973 году.
Все клетки крови были разделены на 6 классов.
1 класс клеток составляют стволовые кроветворные клетки, коли-чественное содержание которых в кроветворной ткани не превышает долей процента. Эти клетки обеспечивают стабильное кроветворения и его восс-тановление после возмущающих воздействий. Стволовая клетка - единс-твенная, способная к самоподдержанию в течение длительного времени, большего, чем продолжительность жизни индивидуума. Стволовые клетки полипотентны и способны дифференцироваться по всем росткам кроветворе-ния. Не исключается, что и лимфопоэз имеет в качестве исходного звена ту же стволовую клетку. Итак, стволовыми названы такие клетки, которые обладают и способностью к неограниченному самоподдержанию, а также способностью к пролиферации и дифференцировке.
Для ретикулярных клеток, фибробластов и эндотелиальных клеток, по-видимому, существуют свои клетки-предшественники. Диаметр стволовой клетки 8-10 мкм, форма клетки круглая или неправильная. Ядро чаще го-могенное, круглое или почкообразное, обычно видны 1-2 больших ядрышка. Ободок светлоголубой цитоплазмы узок, зернистости не содержит. 65% стоволовых клеток дифференцируется по эритроидному пути, 30% - по мие-лоидному и 5% - по мегакариоцитарному.
2 класс клеток - класс полипотентных клеток- предшественников, которые способны к пролиферации и дифференцировке: клетки-предшест-венники Т-лимфоцитов, колинеобразующая клетка культуры служит исходным звеном гистогенеза клеток двух линий: гранулоцитов и моноцитов.
3 класс - класс бипотентных клеток-предшественников типа эритро-поэтинчувствительной и тромбопоэтинчувствительной клетки. Эти три класса являются морфологически недифференцируемыми клетками.
4 класс - унипотентные клетки-предшественники, которые способны дифференцироваться только в направлении одного ростка кроветворения. Эти клетки морфологически распознаваемы. Их называют бластами (по структуре ядра), которые начинают отдельные ряды гемопоэза: плазмоб-ласт, лимфобласт, монобласт, миелобласт, эритробласт, мегакариобласт.
5 класс - класс созревающих клеток.
6 класс - класс зрелых клеток с ограниченным жизненным циклом.
Таким образом, термин недифференцируемые бласты (клетки первых 3 классов) заменил старое название гемоцитобласты. В современной гема-тологии широко применяются цитохимические методы исследования, которые позволяют идентифицировать различные типы клеток крови, степень их зрелости, принадлежность к тому или иному кроветворному ряду.
Классификация лейкозов. В 1857 году Фридрих разделил все лейкозы на острые и хронические. В основу деления был положен морфологический принцип: группу острых лейкозов объединяет общий признак - субстрат опухоли составляют молодые клетки - недифференцируемые клетки первых 3 классов или 4 класс - бласты. Острый лейкоз из морфологически недиффе-ренцированных клеток первых 3 классов называют недифференциремым ост-рым лейкозом. Если опухоль возникает из клеток 4 класса, то его назы-вают по обозначению клетки 4 класса. В группу хронических лейкозов входят дифференцирующиеся опухоли системы крови, основной субстрат ко-торых составляют созревающие и зрелые клетки. Длительность заболевания не влияет на выделение острого и хронического лейкоза, хотя чаще ост-рые лейкозы характеризуются более короткой продолжительностью жизни, а хронические - значительно большей. В то же время при современной ци-тостатической терапии встречаются случаи длитеьного течения острого лейкоза (годы). Напротив, может быть быстрое по срокам течение хро-нических лейкозов.
Уже в начале 20 века острый лейкоз стали подразделять на лимфоб-ластный и миелобластный варианты. Это деление было прежде всего связа-но с наличием или отсутствием фермента миелопероксидазы. Затем в 1964 году в Кэмбридже была создана комиссия по выработке общей классифика-ции острого лейкоза. В её основу была положена морфологическая харак-теристика. В настоящее время в основу классификации острого лейкоза положена цитохимическая характеристика. Острый лейкоз из морфологичес-ки недифференциорованных клеток первых 3 классов называют недифферен-цируемым острым лейкозом. Если опухоль возникает из клеток 4 класса, то его называют по обозначению клетки 4 класса: миелобластный, миело-монобластный, монобластный, промиелоцитарный, острый эритромиелоз, ме-гакариобластный, лимфобластный, плазмобластный, недифференцируемый острый лейкоз.
Диагностика острого лейкоза . Как было сказано выше, острый лейкоз
Злокачественная опухоль кроветворной ткани, морфологическим субстра-том которой являются трансформированные бластные клетки, соответствую-щие родоначальным элементам одного из ростков кроветворения. Постанов-ка диагноза острого лейкоза может быть только морфологической. С этой целью производится стернальная пункция, и лишь резко повышенный про-цент клеток первых 3 классов или клеток 4 класса позволяет поставить диагноз острого лейкоза. Обычно, процент клеток первых 4 классов при остром лейкозе составляет несколько десятков процентов, иногда этот процент равняется 10-20%, это малопроцентная форма острого лейкоза. Если процент бластных клеток ниже этих цифр, можно сделать трепаноби-опсию - исследование костного мозга, взятого из крыла подвздошной кос-ти. При трепанобиопсии обнаруживают скопления молодых клеток в значи-тельном количестве. Если и в этом случае диагноз сомнителен, то следу-ет повторить анализ через 3-4 недели.
В периферической крови при остром лейкозе имеет место разрыв, провал между бластными клетками и зрелыми элементами с отсутствием в миелограмме промиелоцитов и миелоцитов, так называемый hiatus leucemi-cus.
Стадии острого лейкоза: начальная стадия, развёрнутый период (первая атака, рецидив), ремиссия (полная или частичная), выздоров-ление, рецидив острого лейкоза (с указанием какой по счёту) и терми-нальная стадия.
Имеющиеся в настоящее время сведения о начальной стадии острого лейкоза скудны, об этой стадии можно судить лишь ретроспективно. У больных отмечается прогрессивно нарастающая слабость, потливость.
Диагноз может быть поставлен при случайном анализе крови или в фазе разгара заболевания. При развёрнутой клинической симптоматике у больных наблюдается высокая температура, ознобы, головокружения, боли в костях, суставах, анорексия, кровоточивость дёсен. У 55-70% лиц в дебюте заболевания имеет место геморрагический синдром с кровотечения-ми любой локализации и появлением геморрагий на коже, что связано с тромбоцитопенией. При угнетении гранулоцитарного ростка отмечается яз-венно-некротическая ангина, подъём теипературы.
В анализах крови имеет место умеренная анемия, количество лейко-цитов может быть повышенным, нормальным, пониженным, с бластами в пе-риферической крови, отмечается тромбоцитопения. Даже если изменения в периферической крови нечётки, то костный мозг расшифровывает диагноз: в миелограмме обнаруживается несколько десятков % бластов или 100%. Обычно увеличение селезёнки носит умеренный характер, её увеличение совпадает с другими признаками прогрессии. Значительного увеличение печени также не отмечается. Нередко появляются разрастания кожи, при этом лейкозная инфильтрация располагается и в подкожной клетчатке, об-разуя плотные, спаянные с кожей и приподнимающие её узлы. Может быть лейкозная инфильтрация лёгочной ткани и мозга.
Такая клиническая картина характерна для острого миелобластного лейкоза у взрослых.
Ознакомиться с программой диагностики и лечения лейкозов в Израиле .
Острый промиелоцитарный лейкоз несколько выделяется из группы острых лейкозов, прежде всего тем, что промиелоцит - это клетка 5 класса. Видимо, название дано не совсем правильно, и клетка относится к 4 классу, но в обычном световом микроскопе её невозможно отличить от промиелоцита. Отличается резкой злокачественностью течения, выражен-ностью геморрагического синдрома, гипофибриногенемией, быстротой тече-ния. Первым и наиболее типичным признаком заболевания является гемор-рагический синдром. Как правило, речь идёт о появлении синяков на мес-те небольших травм, о кровотечениях из дёсен. Возможно бурное начало болезни: высокая температура, геморрагии, некрозы слизистых оболочек. Почти все больные гибнут от кровоизлияния в мозг или желудочно-кишеч-ных кровотечений. При этом лейкозе патологические клетки имеют зернис-тость, морфологически сходную с зернистостью тучных клеток и базофи-лов, которые содержат гепарин. Иногда этот лейкоз называют ге-
париноцитарным или базофильноклеточным, но термин промиелоцитарный
стал традиционным и наиболее часто употребляется в клинической практи-ке. Раньше именно при этой форме описывали молниеносные формы и дли-тельность жизни больных не превышала 1 месяца. Высокая лихорадка и проливные поты изнуряют больных. В настоящее время в связи с примене-нием новых лекарственных препаратов, в частности рубомицина, увеличи-лась продолжительность жизни больных. Продолжительность жизни равняет-ся в среднем 26 месяцам, и даже описаны формы, когда продолжительность жизни составляла более 4 лет.
Острый монобластный и миеломонобластный лейкозы мало чем отлича-ются от острого миелобластного лейкоза. Также встречаются некротичес-кие поражения ротовой полости, гингивиты, часты лейкемиды кожи, увели-чена селезёнка. Особенность этого вида лейкоза состоит в том, что ре-миссии возникают реже, чем при других видах лейкоза. Средняя продолжи-тельность жизни составляет примерно 3 месяца.
Острый эритромиелоз. Встречается редко. В костном мозге резко увеличивается содержание ядросодержащих клеток красного ряда в костном мозге, сопровождающееся высоким содержанием в нём недифференцируемых бластов, или миелобластов, или монобластов.
Острый лимфобластный лейкоз. Эта форма привлекает внимание онко-логов и гематологов потому, что именно при этой форме применение комп-лексных цитостатических воздействий позволило добиться получения ре-миссии более, чем у 90% больных детей, а у многих больных ремиссии бы-ли столь продолжительными, что можно было говорить о выздоровлении де-тей. Эти данные получены учёными многих стран одновременно. Положи-тельный эффект был стабилен у детей в возрасте от 2 до 9 лет, они были хуже у детей моложе и старше этого возраста, а у лиц старше 20-25 лет различия между лимфобластным и миелобластным острым лейкозом постепен-но стираются, хотя продолжительность жизни и при этих формах выше, чем при остальных формах острого лейкоза. В 80% случаев лимфобластный лей-коз встречается в детском возрасте. Его особенность заключается в уве-личении лимфатических узлов и селезёнки.
Другой осбенностью острого лимфобластного лейкоза у детей являют-ся оссалгии, чаще всего - боли в голенях. Обычно в таких случаях у больных подозревают ревматизм. Начинает развиваться анемия. Проведён-ная пункция костного мозга подтверждает диагноз в связи с наличием лимфобластов. Эти клетки встречается и в пунктате лимфоузла и селезён-ки. В основном этот лейкоз возникает из клеток-предшественников Т-лим-фоцитов. Без терапии течение острого лимфобластного лейкоза не имеет каких-либо особенностей: нарастает угнетение нормальых ростков кро-ветворения, появляются инфекционные осложнения, геморрагии, прогресси-рует анемия. До появления метотрексата, 6-меркаптопурина и преднизоло-на продолжительность жизни больных детей составляла около 2,5-3,5 ме-сяцев, взрослых - 1,4-2 месяца. Течение каждого рецидива болезни ха-рактеризуется некоторым упорством проявления болезни по сравнению с её первым приступом. Нередко процесс метастазирует в яички и мозговые оболочки, т0-есть имеют место явления нейролейкемии. Считают, что по-давляющее большинство случаев острого лимфобластного лейкоза возникают из Т-лимфоцитов.
Существуют и случаи острого лейкоза, развивающиеся из кле-ток-предшественников В-лимфоцитов. Эта группа относится к острым плаз-мобластным лейкозам. Реже встречается острый мегакариобластный лейкоз.
В настоящее время в лейкозологии введено понятие нейролейкемия. Она встречается при всех формах острого лейкоза, а особенноо часто при остром лимфобластном лейкозе у детей, по существу нейролейкемия явля-ется метастатическим процессом,
Её клиническая картина складывается преимущественно из симптомов менингита и гипертензионного синдрома. До тех пор, пока в терапию ост-рого лейкоза не были включены препараты, вводимые эндолюмбально, ней-ролейкемию не удавалось предупредить.
Полная клинико-гематологическая ремиссия при остром лейкозе имеет следующие признаки: нормализация общего состояния больного, наличие в пунктате костного мозга не более 5% бластных клеток, а общее количест-во бластных клеток (менее 5%) и лимфоидных клеток не превышает 40%. При этом в периферической крови бластные клетки отсутствуют, состав крови близок к норме, хотя возможна умеренная лейкопения, около 1,5- 3 х 10.9/л, и тромбоцитопения до 100 х 10.9/л. Отсутствуют клинические признаки лейкозной пролиферации в печени, селезёнке и других органах. Для лимфобластного лейкоза у детей обязательна нормализация спинномоз-говой жидкости.
Выздоровлением от сотрого лейкоза принято считать состояние пол-ной ремиссии на протяжении 5 лет и более.
Частичные ремиссии представляют собой весьма разнообразные состо-яния, которые характеризуются или получением отчётливого гематологи-ческого улучшения с уменьшением процента бластных клеток в костном мозге и спинномозговой жидкости при ликвидации симптомов нейролейке-мии, а также исчезновением бластных клеток из крови.
Рецидив острого лейкоза. Может быть костномозговым (появление более 5% бластов в пунктате) или местным (внекостномозговым) с лю-бой локализацией лейкемической инфильтрации.
Терминальная стадия острого лейкоза наступает, когда все цитоста-тические средства оказываются неэффективными и даже на их фоне отмеча-ется ухудшение картины крови: нарастает гранулоцитопения, тромбоцито-пения, появляются некрозы слизистых, спонтанные кровоизлияния.
Хронические лейкозы
Классификация хронических лейкозов:
1. Хронический миелолейкоз
2. Сублейкемический миелоз
3. Эритремия
4. Хронический мегакариоцитарный
5. Хронический эритромиелоз
6. Хронический лимфолейкоз
Хронический миелолейкоз - опухоль, которая возникает из кле-ток-предшественников миелопоэза, сохраняющих способность дифференциро-ваться до зрелых форм. Субстрат опухоли составляют преимущественно гранулоциты, главным образом, нейтрофилы.
Болезнь характеризуется нарастающим нейтрофильным лейкоцитозом, нередко и гипертромбоцитозом, прогрессирующим увеличением селезёнки. Опухолевый процесс проходит две стадии: развёрнутую - моноклоновую доброкачественную и терминальную - поликлоновую злокачественную. Хро-нический миелолейкоз в развёрнутую стадию представляет собой опухоль нейтрофильного ростка кроветворения, которая практически полностью вы-теснила элементы нормального гранулоцитопоэза.
Патологический клон имеет своей родоначальницей полипотентную ге-мопоэтическую клетку, которая имеет в 22 паре вместо нормальной хромо-сому с укороченным длинным плечом. Начальные признаки болезни связаны либо с увеличением селезёнки, либо с нарастающей интоксикацией. В пер-вом случае больной обращает внимание на тяжесть в животе, появление болей в левом подреберье. В других случаях первыми симптомами являются слабость, потливость, потеря веса. Диагноз устанавливают на основании анализа крови. Это всегда лейкемический процесс, то-есть в крови при-сутствуют молодые клетки нейтрофильного ряда: увеличено содержание палочкоядерных нейтрофилов, метамиелоцитов, миелоцитов, промиелоцитов, в дальнейшем и миелобластов. В лейкоцитарной формуле повышено содержа-ние базофилов, иногда и эозинофилов - "базофильно-эозинофильная ассо-циация". Всегда нарастает лейкоцитоз, повышается содержание тромбоци-тов. Таким образом, нарастающий нейтрофильный лейкоцитоз со сдвигом влево до миелоцитов и промиелоцитов, увеличение числа тромбоцитов, возникающие на фоне удовлетворительного состояния больного, должны на-вести на мысль о хроническом миелолейкозе.
Вместе с тем, нейтрофильный лейкоцитоз и тромбоцитоз, как извест-но, являются частыми реактивными состояниями в ответ на любой клеточ-ный распад в организме и, прежде всего, на раковую опухоль. В этих случаях говорят о лейкемоидных реакциях. Они могут возникнуть как от-ветные реакции костного мозга на раздражения продуктами белкового рас-пада, либо вследствие нарушения целостности костного мозга раковыми метастазами. Обычно диагноз ставится на основании анализа мазка пери-ферической крови. В сомнительных случаях производят стернальную пунк-цию. Обнаруживают резкое относительное увеличение гранулоцитов, соот-ношение лейкоцитов: эритроцитов достигает 10: 1 и 20: 1. Имеет место резкое снижение щелочной фосфатазы.
Развитие хронического миелолейкоза при отсутствии цитостатической терапии храктеризуется постепенным нарастанием патологических явлений: увеличивается селезёнка, усиливается тяжесть в животе, нарастает лейкоцитоз, становится выраженнее интоксикация. При достижении уровня 500 х 10.9/л и более клеток возникает реальная опасность образования лейкоцитарных тромбов в сосудах мозга, селезёнки, лёгких. Распростра-няется лейкозная инфильтрация в печени. Ранее продолжительность жизни больных хроническим миелолейкозом без цитостатической терапии в сред-нем составляла 2,4-2,6 года. Причиной смерти в этот период были прояв-ления терминальной стадии: угнетение нормальных рстков кроветворения, геморрагический синдром, инфекции, некрозы, в 70% связанные с бластным кризом.
В условиях современной цитостатической терапии картина хроничес-кого миелолейкоза отличается от описанной выше. Применение миелосана ведёт к практической нормализации состояния больных: уровень лейкоци-тов удаётся поддерживать в пределах 10-20 х 10.9/л, сохраняются ста-бильными и размеры селезёнки. С годами в периферической крови увеличи-вается содержание более молодых форм, включая промиелоциты. Это равёр-нутая стадия заболевания.
Если больной становится рефрактерным к проводимой цитостатической терапии, нарастает общая интоксикация, снижается содержание тромбоци-тов, то диагностируют терминальную стадию заболевания. Снижение тром-боцитов определяет появление выраженного геморрагического синдрома. Затем присоединяется панцитопения. Самым важным признаком этой стадии является наличие бластных клеток в костном мозге, а затем и в перифе-рической крови. Имеют место признаки миелемии: содержимое костного мозга попадает в периферическую кровь, в основном это касается ядросо-держащих клеток красного ряда и мегакариоцитов. Очаги патологического кроветворения выходят за пределы костного мозга, селезёнки, печени и образуют под кожей лейкемиды кожи. Отмечаются сильные боли в костях, инфаркты селезёнки, стойкое повышение температуры.
Обычно продолжительность жизни больного до терминальной стадии исчисляется годами, а длительной самой терминальной стадии равняется 3-6 месяцам. В крови имеются признаки бластного криза - появление в крови бластных и недифференцируемых клеток, что напоминает картину крови при остром лейкозе. Данный факт подтверждает трёхростковую при-роду хронического миелолейкоза, его возникновение на уровне клет-ки-предшественницы миелопоэза.
Эритремия. Ранее её называли болезнь Вакеза или истинная полици-темия. Заболевание представляет собой доброкачественную опухоль систе-мы крови, развивающуюся из клетки-предшественницы миелопоэза, хотя для некоторых вариантов нельзя исключить и её развитие из эритропоэтин-чувствительной клетки. В кровяном русле и сосудистом депо увеличивает-ся масса эритроцитов, при этом изменяются и их качественные характе-ристики. Так, эти эритроциты дают резко замедленную СОЭ (1-4 мм/час), иногда вплоть до отсутствия оседания эритроцитов).
Больные предъявляют жалобы на головные боли, тяжесть в голове. Иногда первым признаком болезни является покраснение лица и ладоней. Частый симптом эритремии - это кожный зуд. У больных отмечается склон-ность к тромбозам. Тромбы локализуются как в артериях конечнстей с об-разованием некрозов, так и в коронарных и мозговых артериях. Нередко имеет место повышение артериального давления. Увеличивается печень и селезёнка.
Гематологическая картина эритремии довольно характерна: увеличе-ние количества эритроцитов, а также тромбоцитов и лейкоцитов. Наблюда-ется выраженная гиперплазия клеточных элементов в костном мозге, уве-личены все ростки кроветворения, в основном - эритроидный. Как и хро-нический миелолейкоз эритремия имеет две стадии: Развёрнутую доброка-чественную и терминальную злокачественную. Следует проводить дифферци-альную диагностику с симптоматическим эритроцитозом.
Хронический лимфолейкоз . Хронический лимфолейкоз представляет со-бой опухоль лимфоидной ткани - иммунокомпетентной системы. Субстрат опухоли представлен морфологически зрелыми лимфоцитами. Болезнь харак-теризуется лейкоцитозом, обязательной лимфоцитарной пролиферацией в костном мозге, увеличение лимфоузлов, печени и селезёнки. Поражение иммунокомпетентной системы характеризуется склонностью к развитию ин-фекционных осложнений и частое развитие аутоиммунных (гемолитических и тромбоцитопенических) состояний.
Известно, что лимфоциты неоднородны. В 1970 году были выделены тимус-зависимые (Т-лимфоциты), которые ответственны за трансплантаци-онный иммунитет, реакции гиперчуствительности замедленного типа. Эти антигенчувствительные лимфоциты первыми реагируют на появление нового антигена.
Вторая группа - это В-лимфоциты, обнаруженные впервые в бурса Фабрициуса у птиц. Хронический лимфолейкоз может быть представлен Т-клетками и В-клетками. Однако, как правило, хронический лимфолейкоз представлен В-лимфоцитами. Их содержание в крови достигает 80-98%, тогда как количество Т-лимфоцитов снижено до 3-9%. Обнаружены лишь единичные случаи хронического лимфолейкоза, представленного Т-лимфоци-тами. Вероятнее всего, хронический лимфолейкоз возникает из клет-ки-предшественницы лимфопоэза. При этом выявляются некоторые признаки относительной доброкачественности процесса: отсутствуют нарушения в хромосомном наборе, не получено чётких данных об атипизме клеток. Па-тологические клетки при хроническом лимфолейкозе практически неотличи-мы от нормальных лимфоцитов. На протяжении значительного периода бо-лезни отсутствует опухолевая прогрессия. Кроме того заболевание можно контролировать одним цитостатическим средством на протяжении ряда лет, редко встречается и бластный криз в финале болезни.
В то же время в ряде случаев хронический лимфолейкоз, будучи дол-гое время доброкачественной опухолью, трансформируется и обретает чер-ты злокачественности, что проявляется резистентностью опухоли к разно-образной цитостатической терапии. В морфологии лимфоцитов можно обна-ружить черты атипизма, в крови появляются в большом проценте пролимфо-циты и лимфобласты. Отсутствует и связь с мутагенными факторами, что прослежено у лиц, перенёсших воздействие ионизирующей радиации. У жи-телей Хиросимы и Нагасаки, а также у лиц, получавших рентгенотерапию, участились случаи острого лейкоза, хронического миелолейкоза, но не хронического лимфолейкоза.
Заболевание длительно, иногда в течение многих лет, может проте-кать без признаков опухолевой прогрессии. Таким образом, на первых этапах эта опухоль доброкачественная, но при определённых обстоятель-ствах может дать озлокачествление: бластный криз, трансформацию в саркому.
Как было сказано выше, хронический лимфолейкоз состоит преиму-щественно из морфологически зрелых лимфоцитов, разрастающихся в кост-ном мозге, лимфатических узлах, селезёнке, печени и выбрасываемых в большом количестве в периферическую кровь. Диагноз заболевания обычно устанавливается при обнаружении повышенного количества лимфоцитов в периферической крови наряду с увеличением лимфатических узлов. В крови обнаруживаются полуразрушенные ядра лимфоцитов с остатками нуклеол - тени Гумпрехта. В сущности эти клетки лейколиза представляют собой ар-тефакт, в жидкой крови они отсутствуют. Эти клетки образуются в про-цессе приготовления мазка. Во многих тенях Гумпрехта среди глыбок хро-матина можно заметить нуклеолы. Иногда эти клетки лейколиза называют именами Боткина-Гумпрехта, хотя это название не совсем точно. Сын
С.П.Боткина С.С.Боткин описал лизированные клетки в крови при брюшном тифе, но не при хроническом лимфолейкозе. Появление подобных клеток характерно для хронического лимфолейкоза. Иногда в периферической кро-ви отмечается появление единичных пролимфоцитов, реже - единичных лим-фобластов. В пунктате костного мозга отмечается резкое увеличение лим-фоцитов. В трепанате костного мозга встречаются характерные скопления лимфоидных клеток.
Как правило, больной обращается к врачу уже при наличии увеличен-ных лимфоузлов и существенного повышения содержания лимфоцитов. Забо-левание начинается постепенно, в течение нескольких лет в крови может отмечаться лимфоцитоз до 40-50%. Постепенно начинают увеличиваться лимфоузлы на шее, в подмышечных впадинах. На поздних этапах присоеди-няются анемия и тромбоцитопения.
Происхождение хронического лимфолейкоза из клеток иммунокомпе-тентной системы, опухолевая природа этого процесса, обусловливают осо-бенности осложнений, свойственных хроническому лимфолейкозу. Эти боль-ные очень чувствительны к инфекциям бактериальной природы: ангины, пневмонии, нагноительные процессы в лёгких. Кроме инфекционных ослож-нений, хроническому лимфолейкозу свойственны иммунные конфликты, свя-занные с появлением антител против собственных нормальных клеток кро-ви. Чаще всего диагностируется аутоиммунная гемолитическая анемия: появляется желтуха, ретикулоцитоз, снижается содержание эритроцитов и гемоглобина, увеличивается селезёнка. Нередки и аутоиммунные тромбоци-топении. А.И.Воробьёв описывает также аутоиммунные состояния, касающи-еся лейкоцитов.
Терминальное состояние больного может характеризоваться нарастаю-щим истощением, тяжёлыми инфекционными осложнениями, стоматитом, ге-моррагическим синдромом и анемией, вызванными иммунными конфликтами.
"Волосатоклеточный" или ворсинчатоклеточный лейкоз представлен клетками типа В-лимфоцитов. Морфологической особенностью этих клеток является наличие ворсинчатых выступов цитоплазмы. Заболевание характе-ризуется цитопенией, лимфоузлы увеличены умеренно, печент и селезёнка достигают больших размеров. В костном мозге преобладают "волосатые" клетки.
Парапротеинемические гемобластозы
Эта группа объединяет опухолевые процессы в системе иммунокомпе-тентных клеток, осуществляющих функции гуморального иммунитета. К ней относятся три нозологические формы: плазмоцитома, миеломная болезнь, болезни тяжёлых цепей и другие.
Главной особенностью этой группы является способность опухолевых клеток синтезировать однородные иммуноглобулины или их фрагменты - па-рапротеины. Как известно, синтез антител осуществляется в норме полик-лоновой системой плазматических клеток и лимфоцитов, способных специ-фически реагировать практически с любым из возможных антигенов. При этом каждый представитель клона - одна клетка - генетически запрограм-мирована для синтеза только одного вида антител - однородного иммуног-лобулина. При парапротеинемических гемобластозах вся масса опухоли, представляющей потомство одной клетки, генотипически однородна, одно-родна и её продукция - моноклоновый иммуноглобулин. Парапротеин всегда является патологическим белком. В соответствии с современной классифи-кацией иммуноглобулинов парапротеины делятся на 5 классов: A,C,M,D и E.
Плазмоцитома (миеломная болезнь). Могут быть солитарные плазмо-цитомы, множественно-опухолевая форма, диффузно-узловая и диффузные формы. Пролиферирующие в костном мозге миеломные клетки приводят к разрушению костного мозга в плоских костях, позвоночнике, трубчатых костях.
Клинически поражения костей проявляются классической триадой Ка-лера: боли, опухоли, переломы. Специфических рентгенологических приз-наков, позволяющих отличить изменения в костях от метастазов в кости, не существует. Цитологическое исследование костного мозга выявляет специфическую картину миеломноклеточной метаплазии.
Синдром белковой патологии проявляется: гиперпротеинемией с ги-перглобулинемией, повышением СОЭ и вязкости крови, положительными оса-дочными белковыми реакциями. Миеломная нефропатия выражается упорной протеинурией, постепенно развивающейся почечной недостаточностью при отсутствии признаков нефротического синдрома: отёков, гипопротеине-мии, гиперхолестеринемии. Не характерна также гипертензия и ретинопа-тия.
Острый лейкоз - опухоль, состоящая из молодых недифференцированных кроветворных клеток, с обязательным началом в красном костном мозге. Для острых лейкозов характерны следующие признаки: клоновый характер (все клетки, составляющие лейкемическую опухоль, являются потомками одной стволовой клетки или клетки-предшественницы любого направления и уровня дифференцировки), опухолевая прогрессия, гено- и фенотипические (морфологические - атипизм, анаплазия; цитохимические - химическая анаплазия) особенности лейкозных клеток.
На основании морфологических особенностей лейкемических клеток в сочетании с их цитохимическими характеристиками острые лейкозы делят на две большие группы.
Острый лимфобластный лейкоз, происходящий из клеток-предшественниц лимфоидного направления дифференцировки (самая частая форма острого лейкоза у детей - 85%, у взрослых на его долю приходится 20%).
Острые нелимфобластные лейкозы, происходящие из миелоидных клеток-предшественниц (у детей они составляют 15%, у взрослых - 80% общего количества острых лейкозов).
Диагностика острых лейкозов
Для постановки диагноза «острый лейкоз» необходима чёткая морфологическая верификация - обнаружение несомненно бластных клеток в красном костном мозге. Для диагностики острого лейкоза безусловно обязательно установление классической структуры ядра бластных клеток (нежно-хроматиновой - тонкосетчатой с равномерным калибром и окраской нитей хроматина).
Изменения в периферической крови
Ценную информацию при всех гемобпастозах в первую очередь даёт цитоморфологическое изучение клеток периферической крови. При остром лейкозе всем элементам кроветворения свойственны глубокие патологические изменения. В большинстве случаев острого лейкоза развивается анемия. Анемия носит нормохромный или гиперхромный, реже гипохромный характер и углубляется по мере прогрессирования заболевания (концентрация гемоглобина снижается до 60-20 г/л, количество эритроцитов - 1,5-1,0×10 ,2 /л). Другой характерный признак острого лейкоза - тромбоцитопения (часто ниже критического уровня). На протяжении заболевания и под влиянием лечения содержание тромбоцитов подвергается циклическим колебаниям: в начале болезни оно нередко нормальное, при обострении и прогрессировании уменьшается, в период ремиссии возрастает. Общее количество лейкоцитов колеблется в широких пределах - от лейкопении до 100-300×10 9 /л (более высокие показатели фиксируют редко). Лейкоцитоз в момент первичной диагностики острого лейкоза наблюдают менее чем в трети случаев, обычно он сопровождается высоким содержанием бластных клеток. Значительно чаще при первичном исследовании крови количество лейкоцитов бывает нормальным или обнаруживают лейкопению с относительным лимфоцитозом. Обычно среди лимфоидных элементов можно выявить бластные клетки, однако возможны случаи, когда типичные бластные клетки в крови отсутствуют. Лейкопенические формы составляют 40-50% всех случаев острого лейкоза, при этом количество нейтрофилов может уменьшаться до катастрофического уровня (0,2-0,З×10 9 /л). Развитие цитопений (гранулоцитопения, анемия, тромбоцитопения) при остром лейкозе является следствием присущего этому заболеванию угнетению нормального кроветворения. Определённое значение в возникновении цитопений имеет и аутоиммунный цитолитический механизм, который может осложнять течение любого лейкоза.
Начавшись как лейкопенический, острый лейкоз чаще сохраняет эту тенденцию на протяжении всего заболевания. Иногда наблюдают смену лейкопении лейкоцитозом (у нелеченых больных по мере прогрессирования процесса), и наоборот (например, под влиянием цитостатической терапии). Для острого лейкоза характерно так называемое лейкемическое зияние: отсутствие переходных элементов между клетками, составляющими морфологический субстрат болезни, и зрелыми лейкоцитами.
Лейкоз, при котором в периферической крови выявляют патологические бластные клетки называют лейкемическим, а лейкоз (или фазу лейкоза) с отсутствием бластных клеток в крови - алейкемическим.
Изменения в красном костном мозге . Исследование красного костного мозга - обязательное исследование в диагностике острого лейкоза, в том числе и в тех случаях, когда диагноз острого лейкоза не вызывает сомнения уже после исследования периферической крови. Это обусловлено основным правилом онкологии - только изучение субстрата опухоли даёт основание для постановки диагноза.
В красном костном мозге в период манифестации острого лейкоза обычно преобладают бластные формы (более 60%), как правило, отмечают резкое угнетение эритроцитарного ростка и уменьшение количества мегакариоцитов с дегенеративным сдвигом в мегакариоцитограмме.
Диагностика цитопенических форм лейкоза затруднительна, так как картина крови часто напоминает таковую при апластической анемии и агранулоцитозе: анемия, лейкопения (гранулоцитопения и относительный лим-фоцитоз). Костномозговая пункция обычно решает вопросы диагностики. Исключение составляет М7 (мегакариобластный) вариант острого лейкоза при котором выраженное развитие фиброза костного мозга не позволяет получать полноценный пунктат (клеточность низкая, существенная примесь периферической крови). Важный диагностический метод при данной форме острого лейкоза - трепанобиопсия кости. Гистологическое исследование срезов кости позволяет установить выраженную бластную гиперплазию красного костного мозга.
Диагноз острого лейкоза может быть поставлен в следующих случаях.
Бластные клетки составляют не менее 30% среди всех клеточных элементов красного костного мозга;
При преобладании в костном мозге эритрокариоцитов (более 50%) бласты составляют не менее 30% среди неэритроидных клеток (при остром эритромиелозе).
В костном мозге преобладают морфологически характерные гипергранулярные атипичные промиелоциты (острый промиелоцитарный лейкоз).
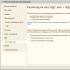
В других, более редких, случаях обнаружение 5-30% миелоидных бластов среди всех клеток костного мозга позволяет говорить о диагнозе миелодиспластического синдрома, а именно о рефрактерной анемии с увеличенным содержанием бластов (ранее эта форма миелодиспластического синдрома называлась малопроцентным острым лейкозом). При установлении лимфоидной природы бластных клеток приходится исключать злокачественную лимфому в стадии генерализации. В настоящее время используют ФАБ-классификацию миелодиспластического синдрома.
ФАБ-классификация миелодиспластического синдрома
|
Форма миелодиспла стического синдрома |
Критерии |
| Рефрактерная анемия |
<1%, моноцитов <1×10 9 /л, содержанием бластов в красном костном мозге <5% и кольцевых сидеробластов <15% |
|
Рефрактерная анемия с кольцевыми силеробластами |
Анемия с количеством бластов в периферической крови <1%, моноцитов <1×10 9 /л, содержанием бластов в красном костном мозге <5% и кольцевых сидеробластов >15% |
|
Рефрактерная анемия с избытком бластов |
Анемия с количеством бластов в периферической крови 1-5%, моноцитов <1×10 9 /л, либо с содержанием бластов в красном костном мозге 5-20% |
|
Рефрактерная анемия с избытком бластов в стадии трансформации в острый лейкоз |
Анемия с количеством бластов >5% в периферической крови или >20%, но менее 30% в красном костном мозге, или наличие палочек Ауэра в бластах в периферической крови или красном костном мозге |
|
Хронический миело-монобластный лейкоз |
Количество бластов в периферической крови <5%, моноцитов >1×10 9 /л; содержание бластов в костном мозге <20% |
Трепанобиопсия необходима при дифференциальной диагностике острого лейкоза и лимфосаркомы. При остром лимфобластном лейкозе инфильтрация бластными клетками бывает диффузной, для лимфосаркомы более характерно гнёздное расположение бластных клеток на фоне сохранённой гемопоэтической ткани.
Для идентификации той или иной формы лейкоза при выявлении повышенного содержания бластных клеток в красном костном мозге можно использовать алгоритм диагностики острых миелоидных лейкозов и миелодиспластического синдрома, предлагаемый учёными ФАБ-группы.
Учитывая неспецифичность клинических проявлений острого лейкоза диагностика заболевания основана на поэтапном применении комплекса лабораторно-инструментальных исследований. Первый этап диагностики - установление самого факта наличия у больного острого лейкоза с помощью цитологического исследования мазков крови и костного мозга. При обнаружении в мазках крови или костного мозга?20% бластных клеток можно предположить наличие у больного острого лейкоза.
Дифференциальный диагноз проводится с заболеваниями и состояниями, сопровождающимися увеличением бластных клеток в крови и/или костном мозге. Для подтверждения диагноза острого лейкоза исключаются бластный криз хронического миелолейкоза, лимфобластная лимфома, миелодиспластический синдром лейкемоидные реакции.
Второй этап диагностики - разделение острых лейкозов на две группы: острые нелимфобластные лейкозы и острые лимфобластные лейкозы. С этой целью кроме цитологического осуществляется цитохимическое и иммунологическое исследование образцов костного мозга.
Третий этап диагностики - подразделение острых лейкозов на формы, характеризующиеся определенным прогнозом и особенностями терапии. Для этого наряду с вышеперечисленными методами исследования используются также цитогенетические, молекулярно-генетические, иммуногистохимические и некоторые другие методики. Комплекс методов, используемых в процессе диагностики острых лейкозов, представлен в таблице 2.
Таблица 2. Методы исследований при острых лейкозах
|
Морфологические |
|
|
Цитохимические |
|
|
Иммунологические(изучение клеточных маркеров) |
|
|
Цитогенетические Молекулярно-генетические |
|
|
Дополнительные |
|
|
Инструментальные |
|
Световая микроскопия мазков крови и костного мозга, отпечатков гистологических препаратов костного мозга остается основным методом диагностики острого лейкоза. Обнаружение в мазках крови и/или костного мозга? 20% бластных клеток является основанием для установления диагноза.
Цитохимические исследования мазков костного мозга позволяют идентифицировать острый лимфобластный лейкоз и М1-М6 варианты острых нелимфобластных лейкозов. Для ОЛЛ характерна положительная РАS-реакция в виде крупных гранул и блоков. Для ОНЛЛ - положительная реакция на миелопероксидазу и Судан В.
Картина периферической крови у больных острым лейкозом вариабельна. В дебюте заболевания в периферической крови может наблюдаться снижение уровня гемоглобина и числа эритроцитов, тромбоцитопения (редко тромбоцитоз), лейкопения или гиперлейкоцитоз, нейтропения, сдвиг лейкоцитарной формулы до промиелоцитов или бластов. Часто в лейкоцитарной формуле имеет место провал между молодыми (бластными клетками) и зрелыми гранулоцитарными клетками.
Гистологические методы исследования имеют принципиальное значение при так называемом “сухом” костном мозге, когда получить пунктат и оценить морфологию костного мозга не удается. Такая ситуация встречается в 10% случаев. В этом случае проводится цитологическое исследование отпечатка трепаната костного мозга, а гистологический и иммуногистохимический анализ позволяет с определенной точностью установить диагноз острого лейкоза. Следует отметить, что в ряде случаев гистологическая картина может быть смазана, что требует проведения дифференциального диагноза с бластным кризом хронического миелолейкоза, лимфобластной лимфомой и миелодиспластическим синдромом. Гистологический метод позволяет также установить или подтвердить предположение о мегакариобластном лейкозе, характеризующимся миелофиброзом, увеличением ретикулиновых волокон, увеличением бластных клеток на фоне повышенного числа зрелых или атипичных мегакариоцитов. Особенно точен для диагностики М7 варианта ОНЛЛ метод иммуногистохимии.
Ультраструктурная цитохимия позволяет определять на ранних стадиях дифференцировки бластных клеток миелопероксидазу в миелобластах и мегакариобластах и диагностировать М0 и М7 варианты ОНЛЛ. Использование этого метода доказало, что в 80% случаев при острых недифференцированных лейкозах бластные клетки содержат гранулы миелопероксидазы, что позволяет относить их миелоидным формам.
Иммунофенотипирование бластных клеток, особенно при использовании проточного цитометра, позволяет осуществить подразделение клеток на лимфобласты и миелобласты, идентифицировать М0, М6, М7 варианты ОНЛЛ, верифицировать формы ОЛЛ, диагностировать бифенотипичный острый лейкоз. Одновременное использование 3-х или 4-х красящих меток позволяет выявлять экспрессию на бластной клетке определенной комбинации кластеров дифференцировки (CD), что в последующем позволяет отслеживать эти клетки для диагностики резидуальной болезни.
Цитогенетичекие методы исследования являются необходимыми для подтверждения диагностики некоторых форм острых лейкозов (например, Острый лейкоз довольно редкое заболевание - лишь 3% от всех злокачественных опухолей человека, однако неспецифичность клинической картины с возможным вовлечением в патологический процесс многих органов и систем, тяжелое, прогрессирующее течение заболевания при отсутствии своевременной диагностики на ранних этапах неизбежно ведущее к смерти больного, диктует необходимость знания диагностики данной патологии врачами любой специальности.
Обследовать больного (сбор анамнеза, внешний осмотр, проведение перкуссии и аускультации внутренних органов).
Использовать данные физикального, инструментального, рентгенологического исследования, лабораторных данных для постановки диагноза.
Учитывая жалобы, анамнез, данные физикального осмотра выделять основные клинические синдромы острого лейкоза.
Используя показатели периферической крови, миелограммы, цитохимического исследования выставить форму острого лейкоза, стадию заболевания, оценить прогноз для конкретного пациента.
Проблемы здоровья и экологии
УДК 616.155.392-036.11-074
СОВРЕМЕННЫЕ АСПЕКТЫ
ЛАБОРАТОРНОЙ ДИАГНОСТИКИ ОСТРЫХ ЛЕЙКОЗОВ (ОБЗОР, ЧАСТЬ 1)
С. А. Ходулева, Д. В. Кравченко Гомельский государственный медицинский университет
В обзоре дана краткая историческая справка развития лейкозологии, представлены эпидемиология, этиопа-тогенез и основные клинические проявления острых лейкозов. Подробно изложены диагностические критерии верификации диагноза острого лейкоза и его варианта на основании данных морфологического, цитохимического, иммунологического и цитогенетического методов исследования. Даны современные направления в классификации острых лейкозов с учетом молекулярно-биологического анализа. Представлены молекулярно-генетические прогностические факторы при лимфобластных и нелимфобластных вариантах острого лейкоза.
Ключевые слова: острый лейкоз, бластные клетки, цитохимия, иммунология, цитогенетика.
PRESENT-DAY ASPECTS
OF LABORATORY DIAGNOSTICS OF ACUTE LEUKEMIAS (REVIEW, PART 1)
S. A. Hoduleva, D. V. Kravchenko Gomel State Medical University
In the review there is some historical information about the development of leukosology. The epidemiology, etiopathogenesis and the main clinical manifestations of acute leukemia diagnostics have been also given. The diagnostic criteria of diagnosis verification of acute leukemia and its variants based on the data of morphologic, cyto-chemical, immunological and cytogenetic methods of investigation have been expounded. The present-day ways to classify acute leukemias subject to molecular biological analysis have been given. The molecular genetic predictors in lymphoblastic and non-lymphoblastic variants of acute leukemia have been presented.
Key words: acute leukemia, blast cells, cytochemistry, immunology, cytogenetics.
Острый лейкоз (ОЛ) - злокачественная опухоль кроветворной ткани, характеризующаяся замещением нормального костного мозга незрелыми бластными клетками без дальнейшей их дифференциации в нормальные зрелые клетки крови. Термин «лейкемия» (лейкоз) был введен в 1856 г. немецким патологом Р. Вирховом, который методом световой микроскопии описал избыточное количество белых кровяных телец у больных с гепатос-пленомегалией и изменением цвета и консистенции крови. Диагноз острого лейкоза впервые был поставлен русскими и немецкими врачами E. Freidreich (1857), К. Славянским (1867), B. Kussner (1876), которые сообщили о быстро прогрессирующем течении лейкозного процесса с характерными клиническими проявлениями. В 1877 г. П. Эрлих разработал способ окраски мазков крови, что позволило ему детально описать патологические клетки при ОЛ. Но лишь в 1889 г. после анализа В. Эбштейном 17 наблюдений острого течения лейкоза ОЛ был признан самостоятельной нозологической формой . Терапия ОЛ изначально складывалась из симптоматических мер, что только облегчало состояние больных. Предпринимались попытки лечения мышьяком, кото-
рые не принесли результатов. До 40-х гг. ХХ в. выживаемость больных ОЛ оставалась крайне низкой. Начиная с 1948 г., отмечается значительный прогресс в лечении ОЛ, что связано с широким внедрением в лечебную практику цитостатических препаратов.
На долю острых лейкозов приходится около 3 % среди всех злокачественных опухолей человека, среди гемобластозов - 1/3. Заболеваемость ОЛ составляет 3-5 случаев на 100 тыс. человек в год. В детском возрасте в 80-90 % случаев диагностируется лимфобластный вариант ОЛ (ОЛЛ), в то время как у взрослых пациентов соотношение нелимфобластных (миелоид-ных) и лимфобластных лейкозов в среднем составляет 6/1. Прогресс в лечении ОЛ, благодаря использованию программной полихимиотерапии и трансплантации гемопоэтической стволовой клетки позволяет достигнуть выздоровления (безрецидивная ремиссия более 5 лет) у 3040 % взрослых пациентов с ОЛЛ и у 15-20 % - с острым миелобластным лейкозом (ОМЛ) и до 90 % у детей с ОЛЛ .
В настоящее время общепризнанной считается клоновая теория патогенеза ОЛ, согласно которой лейкозные клетки являются потомством одной мутировавшей гемопоэтической
Проблемы здоровья и экологии
клетки-предшественницы. Мутация родоначальной клетки происходит под влиянием различных этиологических факторов (радиация, химические вещества, вирусы, ионизирующее излучение и др.) и заключается в обширном повреждении ДНК, генетического аппарата клетки. В результате этого в лейкозных клетках происходит нарушение процессов пролиферации и дифференцировки. Одна мутировавшая клетка после деления дает огромное количество бласт-ных клеток, и при их общем числе 1012 и более начинаются клинические проявления заболевания . Основные клинические синдромы ОЛ: гиперпластический, геморрагический, анемический, инфекционно-токсический.
С целью объединения морфологических и цитохимических основ дифференциации ОЛ в 1976 г. франко-американо-британской группой гематологов была разработана FAB-классификация ОЛ, пересмотренная и дополненная в 1991 г. в соответствии с которой ОЛ разделены на две большие группы: нелимфобластные (миелоидные) и лимфобластные лейкозы. Данная классификация до сих пор остается наиболее распространенной и широко используемой в клинической практике за исключением классификации ОЛЛ, основанной исключительно на морфологических отличиях бластных клеток, в связи с отсутствием ее прогностической значимости. ОЛЛ со зрелым В-фенотипом (Л3) относится к группе неходжкинских лимфом .
FAB-классификация ОЛ (1976 г., 1991 г.)
Нелимфобластные (миелоидные) лейкозы:
М0 - острый миелобластный лейкоз с минимальной миелоидной дифференцировкой (3-5 %);
М1 - острый миелобластный лейкоз без признаков созревания бластов (15-25 %);
М2 - острый миелобластный лейкоз с признаками созревания клеток (25-35 %);
М3 - острый промиелоцитарный лейкоз (6-10 %);
М3м (подтип) - микрогранулярный про-миелоцитарный лейкоз;
М4 - острый миеломонобластный (мие-ломоноцитарный) лейкоз (15-17 %);
М5 - острый монобластный (моноцитар-ный) лейкоз (3-8 %);
М5а (подтип) - без созревания клеток;
М5б (подтип) - с частичным созреванием клеток;
М6 - острый эритромиелоз (эритролейкоз) (4-6 %);
М7-острый мегакариобластный лейкоз (2-5 %);
Лимфобластные лейкозы:
Л1 - острый микролимфобластный лейкоз;
Л2 - острый лимфобластый лейкоз;
Л3 - острый макролимфобластный лейкоз (типа лимфомы Беркитта).
В 1999 г. международной группой экспертов была создана новая классификация гематологических опухолей - классификация ВОЗ, согласно которой варианты ОЛ дифференцируются с учетом их генотипа, иммунофенотипа, возникновения после предшествующей химиорадиотерапии . Так, ОМЛ в этой классификации подразделяется на четыре категории: 1) ОМЛ, ассоциированный со стабильно выявляемыми транслокациями; 2) ОМЛ с мультилинейной дисплазией; 3) ОМЛ после предшествующей химиотерапии; 4) другие формы ОМЛ.
В первую категорию включены следующие лейкозы: ОМЛ с транслокацией (8;21) (q22; q22) и химерным транскриптом AML1-ETO; ОМЛ с инверсией 16 (p13;q22) или транслокацией (16;16) (p13;q22) и химерным транскриптом CBFbeta-MYH1 и увеличением числа аномальных эозинофилов; острые промиелоци-тарные лейкозы с транслокацией (15;17) (q22;q12) и химерным транскриптом PML-RARa и другими транслокациями; ОМЛ с аномалиями 23 сегмента длинного плеча 11 хромосомы (11q23) или тандемными повторами MLL-гена.
Во вторую категорию входят ОМЛ, которые морфологически характеризуются мультилинейной дисплазией костного мозга, развившиеся либо на фоне предшествующего миелодиспла-стического синдрома, миелопролиферативного заболевания либо как первичные лейкозы.
саркома .
В связи с ограниченной доступностью молекулярно-генетического исследования данная классификация ОЛ пока не получила широкого применения в клинической практике.
В соответствии с последними рекомендациями ВОЗ (1999 г.), основным диагностическим критерием ОЛ является обнаружение бластных клеток в костном мозге (КМ) более 25 % . В световом микроскопе при окраске мазка КМ или периферической крови (ПК) по Романовскому-Гимзе бластные клетки характеризуются нежно-сетчатой структурой ядерного хроматина, базофилией цитоплазмы и присутствием в ядре четко очерченных голубоватых ядрышек. Морфологический метод при диагностике ОЛ является лидирующим, однако он позволяет определить принадлежность опухолевых клеток к миелоидной или лимфоидной линиям кроветворения лишь в 70 % случаев при обнаружении азурофильной
Проблемы здоровья и экологии
зернистости и палочек Ауэра у миелобластов. Для более точной дифференцировки необходимы другие диагностические подходы: иммунофенотипи-рование, цитохимическое, цитогенетическое и молекулярно-биологическое иследования.
Картина ПК при ОЛ вариабельна. В большинстве случаев выявляется анемия, тромбоцитопения и нейтропения. Анемия обычно нормохромная, нормоцитарная, гипорегенераторная, более выражена при ОМЛ (в частности, при М6), чем при ОЛЛ. Глубокая инициальная тромбоцитопения особенно характерна для острого промиелоцитарного лейкоза (М3). В 1-2 % случаев при ОМЛ наблюдается тром-боцитоз. Количество лейкоцитов может колебаться в достаточно широких пределах - от 1,0*109/л до 100,0х109/л и более. Зачастую в ПК определяется феномен «провала»: отсутствие промежуточных форм между бластными клетками и зрелыми нейтрофильными гранулоцитами. Хотелось бы обратить внимание на то, что в 6 % случаев инициальные проявления ОЛЛ в детском возрасте, по данным анализа ПК, характеризуются исключительно лимфоцитозом .
В 60-е гг. прошлого века наряду с морфологическим методом диагностики ОЛ получает свое развитие цитохимический метод исследования. И уже в 70-е гг. морфологические и цитохимические характеристики бластных клеток становятся основным критерием лабораторной диагностики варианта ОЛ. Благодаря цитохимии удается охарактеризовать линейную направленность дифференцировки лейкозных клеток ОМЛ (гранулоцитарная, моноцитарная, эритроидная линии) и определить ее степень.
Цитохимические реакции, используемые для дифференциальной диагностики варианта ОЛ, включают: 1) выявление миелопероксидазы (МПО) и (или) липидов (ЛП) в реакции с суданом черным; 2) исследование активности неспецифических эстераз (альфа-нафтилацетатэстераза (АНАЭ) и (или) альфа-нафтилбутиратэстераза (АНБЭ)) с оценкой чувствительности к ингибированию фторидом натрия; 3) ШИК-реакции с гликогеном; 4) кислой фосфатазы (КФ).
ШИК-реакция позволяет отдифференцировать ОЛЛ от ОМЛ: при ОЛЛ выявляется гранулярный продукт реакции, при ОМЛ - диффузная реакция. МПО и ЛП - высокоспецифичные маркеры миелоидной дифференци-ровки, выявление которых необходимо для подтверждения ОМЛ. Выявление НЭ (чувствительной к фториду натрия) указывает на моноцитарную природу лейкозных клеток. Определение КФ может указывать на Т-клеточный ОЛЛ (90 % случаев) или на М3-вариант ОМЛ. При ОЛЛ у всех типов лимфобластов реакции на ЛП, МПО, НЭ являются отрицательными .
Открытие в конце 70-х гг. ХХ в. на поверхности гемопоэтических клеток специфических антигенов явилось новым этапом в диагностике ОЛ с использованием метода иммунофенотипирования бластных клеток. К настоящему времени на мембране и в цитоплазме гемопоэтических клеток определено более 150 специфических белков-антигенов, сгруппированных в так называемые кластеры дифференцировки (CD). Каждый из CD-антигенов с помощью моноклональных антител выявляется на нормальных гемопоэтических клетках соответствующей линейной принадлежности и на определенных стадиях дифференци-ровки. Обнаружение одномоментной экспрессии на клетке антигенов, в норме вместе не встречающихся, свидетельствует об аберрантном (лей-кемическом) иммунофенотипе .
К задачам иммунофенотипирования как современного метода диагностики можно отнести следующие: 1) подтверждение диагноза; 2) установление варианта ОЛ в том случае, когда цитоморфологический метод не достаточно информативен (например, при установлении диагноза ОМЛ с минимальной дифференцировкой - М0-вариант); 3) определение бифенотипических и билинейных вариантов острых лейкозов; 4) характеристика аберрантного иммунофенотипа в дебюте заболевания с целью дальнейшего мониторинга минимальной остаточной популяции клеток в период ремиссии острого лейкоза; 5) выделение прогностических групп .
Бластные клетки считаются позитивными по экспрессии того или иного антигена, если 20 % и более экспрессируют его. К антигенам, определяемым на клетках лимфоидной принадлежности, относят CD 1, CD 2, CD 3, CD 4, CD 5, CD 7, CD 8, CD 9, CD 10, CD 19, CD 20, CD 22, CD 23, CD 56, CD 57; CD79а, миелоидной - CD 11, CD 13, CD 14, CD 15, CD 33, CD 36, CD 41, CD 42, CD 65. Определенное сочетание указанных антигенов на бластных клетках, позволяет разделять ОЛ в рамках лимфоидной линии дифферен-цировки на несколько субвариантов . В настоящее время широкое применение получила классификация ОЛЛ, разработанная в 1995 году Европейской группой по иммунологической характеристике лейкемий (European Group for the Immunological characterisation of Leukemias, EGIL) (таблица 1) .
Для ОЛЛ иммунофенотипирование стало особенно принципиальным диагностическим методом, поскольку программы лечения различных подтипов ОЛЛ существенно различаются. Для ОЛЛ В-линии факторами определения тактики лечения являются возраст, инициальный лейкоцитоз и цитогенетические аномалии. Для Т-клеточного ОЛЛ нет признаков, влияющих на выбор терапии, он сам по себе является прогностически неблагоприятным и тре-
Проблемы здоровья и экологии
бует более интенсивного лечения. Дифференцированный подход к терапии различных иммунофенотипических вариантов ОЛЛ позволил до-
биться значительных успехов как в достижении полных ремиссий, так и получении длительной выживаемости больных .
Таблица 1 - Иммунологическая классификация ОЛЛ (EGIL, 1995)
ОЛЛ Т-линии: CD3+ цитоплазматический или мембранный; большинство случаев: ТдТ+, HLA-DR-, CD34-, но эти маркеры не играют роли в диагностике и классификации
про-Т-ОЛЛ (Т I) CD7
пре-Т-ОЛЛ (Т II) CD2 и/или CD5 и/или CD8
кортикальный Т-ОЛЛ (Т III) CD1a+
зрелый Т-ОЛЛ (Т IV) CD3+ мембранный CD1a-
ОЛЛ В-линии: CD19+ и (или) CD79а+ и (или) CD22+ цитоплазматический;
экспрессия не менее чем двух из трех пан-В-клеточных маркеров;
большинство случаев ТдТ+ и HLA-DR+, зрелый В-ОЛЛ часто ТдТ-
про-В-ОЛЛ (В I) Нет экспрессии других маркеров
Common-ОЛЛ (В II) CD10+
пре-В-ОЛЛ (В III) цитоплазматический IgM+
зрелый В-ОЛЛ (В IV) цитоплазматический или поверхностный каппа+ или ламбда+-цепи Ig
Для подтверждения миелоидной (грануло-цитарной и моноцитарной) природы лейкоза наиболее распространенными и широко применяемыми являются антигены кластеров CD13 и CD33. Оценка этих маркеров позволяет подтвердить миелоидную природу бластных клеток в 98 % случаев ОМЛ .
Использование стандартной панели моноклональных антител в 1-2 % не имеет признаков линейной дифференцировки и попадает в группу острого недифференцированного лей-
Прогностическая значимость аберрантной экспрессии маркеров при острых лейкозах пока недостаточно ясна. Существуют данные, например, что обнаружение миелоидных маркеров как при В-клеточном, так и при Т-клеточном ОЛЛ не влияет на результаты лечения . И, наоборот, наличие лимфоидных маркеров при ОМЛ является неблагоприятным фактором в плане терапии. С другой стороны, есть публикации, доказывающие, что выявление CD2, CD7 антигенов на миелоидных клетках свидетельствует о благоприятном течении ОМЛ . Результаты лечения бифенотипических ОЛ существенно хуже, нежели ОЛЛ или ОМЛ.
коза (ОНдЛ), что представляет собой достаточно серьезную проблему на современном этапе диагностики и лечения ОЛ.
В 20-35 % случаев ОМЛ или ОЛЛ встречается бифенотипический ОЛ, диагноз которого устанавливается в тех ситуациях, когда при иммунофенотипировании на мембране этих клеток экспрессируются принципиально значимые маркеры (как лимфоидные, так и мие-лоидные) в сумме 2 и более баллов для каждой из присутствующих линий (таблица 2).
Заключительный этап диагностики ОЛ включает цитогенетическое и молекулярнобиологическое исследования бластных клеток, позволяющие оценить состояние хромосомного аппарата. Практическое значение цитогенетического анализа при острых лейкозах в последнее десятилетие стало общепризнанным, поскольку его данные позволяют уточнить вариант заболевания, проводить динамическое наблюдение за больным в период ремиссии и (или) рецидива, оценивать прогноз. Последнее особенно важно для планирования адекватной, в том числе и высо-кодозовой терапии.
Таблица 2 - Диагностика бифенотипического острого лейкоза (по А. И. Воробьеву, 2002)
Направленность дифференцировки клеток 0,5 балла 1 балл 2 балла
Миелоидная CD11b,CD11, CD15 CD33, CD13, CD14 МПО
В-лимфоидная ТДТ, реарранжировка генов тяжелой цепи Ig CD10, CD19, CD24 ^D22^-m
Т-лимфоидная ТДТ, CD7 CD2, CD5, реарранжировка генов Т-клеточных рецепторов ^D3
Примечание. С - цитоплазматический антиген; МПО - миелопероксидаза; ТДТ - терминальная де-оксирибонуклеотидил трансфераза.
Проблемы здоровья и экологии
Аномалии кариотипа (числовые и структурные) выявляются примерно у 60-80 % пациентов с ОЛ. В настоящий момент установлено влияние определенных цитогенетических аберраций на течение и прогноз различных вариантов ОЛ (основные из них представлены в таблице 3). Например, инверсия 16 хромосомы часто определяется у больных с миеломонобласт-ным лейкозом и высокой эозинофилией в костном мозге (более 3 %), транслокация (15, 17) - типичный маркер острого промиелоцитарного лейкоза, транслокация (8; 21) - определяется у 40 % больных с М2-вариантом острого мие-лоидного лейкоза. Данные транслокации характеризуют группу благоприятного прогноза при ОМЛ. Для оМл с t (8; 21) и t (15; 17) созданы программы дифференцированного лечения, которые позволяют практически у 70 % пациентов добиться длительной безрецедивной ремиссии .
Вторичные лейкозы, индуцированные химиотерапией и (или) радиотерапией, чаще всего характеризуются изменениями 5 и 7 пар хромосом, аномалиями q23 сегмента 11 хромосомы и свидетельствуют о крайне неблагоприятном прогнозе в плане выхода в ремиссию .
При ОЛЛ принципиальным является обнаружение транслокации (9;22) ВСR/АВL и аномалии региона 11q23 или (4; 11) как факторов резко неблагоприятного прогноза. К группе с хорошим прогнозом относится транслокация t (12; 21) ТЕТ/АМТЛи гипердиплоидии . Лейкозы с t (9; 22) (q34; ql1) (Ph-позитивные) составляют до 5% ОЛЛ у детей и 15-30 % у взрослых. Данная транслокация как и при хроническом миелолей-козе приводит к обмену между участками q34
хромосомы 9 и q11 хромосомы 22. Участок гена АВL (аЬекоп proto-oncogene, 9q34) транслоциру-ется в BCR-ген (breakpoint cluster region gene, 22ql1), образуя химерный ген BCR/ABL. Его производным является белок с тирозинкиназной активностью, которая значительно превышает активность нормального белка АВL и является ключевым звеном в патогенезе острых лейкозов с t (9; 22) (q34; ql1). В зависимости от точки разрыва гена BCR может синтезироваться химерный белок с молекулярной массой 210-kD (характерен для хронического миелолейкоза) или 190-kD (характерен для ОЛЛ). Оба белка можно определить с помощью полимеразной цепной реакции. Ph-позитивный ОЛЛ является прямым показанием к проведению аллогенной трансплантации гемопоэтических стволовых клеток, так как частота достижения полных ремиссий при использовании стандартных схем полихимиотерапии при данном варианте ОЛЛ колеблется от 50 до 75 % при продолжительности их менее 10 месяцев, а 3-летняя выживаемость составляет 5-20 % как у детей, так и у взрослых .
Выявление клональных аномалий, характерных для клеток опухоли конкретного пациента, позволяет отслеживать эти клетки в динамике заболевания на молекулярно-генетическом уровне и определять минимальную резидуальную клеточную популяцию. Идентификация и молекулярная характеристика генов, поврежденных в результате хромосомных изменений, приводит к пониманию молекулярных основ злокачественной трансформации и к разработке в дальнейшем направленной терапии.
Таблица 3 - Цитогенетические аномалии при ОЛ
Цитогенетический маркер Связь с FAB-типом Прогноз
t М2 Благоприятный
t (с образов. PML-RARa гена) М3 Благоприятный
inv(16) (p13;q22) и ее вариант t М4 Благоприятный
Нормальный кариотип Разные Средний
inv (3) (q21;q26) / t (q21; q26) М1, М4 Неблагоприятный
11q23 М4, М5 Неблагоприятный
t (p23; q34) Разные Неблагоприятный
t (p11; p13) Разные Неблагоприятный
Моносомия (-7) и делеция 7q- Разные Неблагоприятный
Трисомия (+8) и (+13) Разные Неблагоприятный
Моносомия(-5) и делеция 5q- Разные Неблагоприятный
Гиперплоидия Разные Благоприятный
t с образов. гена TEL/AML1 Разные Благоприятный
t (9; 22) Common-ОЛЛ Неблагоприятный
t у детей больше 10 лет Разные Неблагоприятный
t ; t ; t ; t В-Олл Неблагоприятный
Проблемы здоровья и экологии
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Клиническая онкогематология. Острые лейкозы / М. А. Волкова. - М.: Медицина, 2001. - Гл. 6. - С. 96-161.
2. Руководство по гематологии: в 3 т. / А. И. Воробьев [и др.]; под общ. ред. А. И. Воробьева. - М.: Ньюдиамед, 2002. - Т. 1. - 530 с.
3. Основы клинической гематологии. Острые лейкозы /
B. Г. Радченко. - СПб.: Диалект, 2003. - Гл. 5. - С. 92-107.
4. Гематология. Острые лейкозы: новейший справочник / К. М. Абдулкадыров. - М.: Эксмо; СПб.: Сова, 2004. - Гл. 16. -
5. Ключи к диагностике острых лейкозов / В. М. Погоре-лов, Г. И. Козинец // Гематология и трансфузиология. - 2008. - № 5. - С. 27-31.
6. Принципы и возможности стандартизации морфоцитохимической диагностики острых лейкозов / В. М. Погорелов [и др.] // Клиническая лабораторная диагностика. - 2006. - № 7. - С. 20-22.
7. Betz, B. L. Acute myeloid leukemia diagnosis in the 21st century / B. L. Betz // Arch Pathol Lab Med. - 2010. - Vol. 34, № 10. - Р. 1427-1433.
8. Коленкова, Г. В. Маркеры острого лейкоза в диагностике и прогнозе заболевания у детей / Г. В. Коленкова // Гематология и трансфузиология. - 2002. - Т. 47, № 2. - С. 28-35.
9. Modern diagnostics in acute leukemias / T. Haferlach // Crit Rev Oncol Hematol. - 2005. - Vol. 56, № 2. - Р. 223-234.
10. Френкель, М. А. Современная диагностика острых лейкозов / М. А. Френкель // Клиническая лабораторная диагностика. - 1999. - № 1. - С. 25-32.
11. Предложения для иммунологической классификации острых лейкозов / М. К. Бене [и др.] // Гематология и трансфузиология. - 1997. - Т. 42, № 6. - С. 43-45.
12. Совершенствование комплексной диагностики острых лейкозов у детей в Республике Беларусь / О. В. Алейникова [и др.] // Гематология и трансфузиология. - 2002. - Т. 47, № 2. - С. 42-44.
13. Molecular markers in hematology and oncology / А Schmidt // Praxis (Bern 1994). - 2010. - Vol. 99, № 19. - Р. 1143-1452.
14. Molecular methods for diagnostics and assessment of treatment effectiveness in modern pediatric hematooncology / M. Dawidowska // Postepy Biochem. - 2006. - Vol. 52, № 4. - Р. 408-416.
15. Molecular genetics in acute myeloid leukemia / U. Bacher // Curr Opin Oncol. - 2010. - Vol. 22, № 6. - Р. 646-655.
16. Karyotyping, FISH and PCR in acute lymphoblastic leukemia: competing or complementary diagnostics? / L. Olde Nordkamp // J Pediatr Hematol Oncol. - 2009. - Vol 31, № 12. - Р. 930-935.
17. Molecular diagnostics of malignant disorders / M. G. Rose // Clin Adv Hematol Oncol. - 2004. - Vol 10, № 2. - Р. 650-660.
18. Critical study of prognostic factors in childhood acute lymphoblastic leukemia: differences in outcome are poorly explained by the most significant prognostic variables / J. Donadieu // British Journal of Hematology. - 1998. - Vol. 102. - P. 729-739.
Поступила 15.12.2010
УДК 612.796.071:577
ВАРИАБЕЛЬНОСТЬ СЕРДЕЧНОГО РИТМА У СПОРТСМЕНОВ
Ю. Э. Питкевич
Республиканский центр спортивной медицины, г. Минск Белорусская медицинская академия последипломного образования, г. Минск
Показаны основные современные направления развития и применения вариабельности сердечного ритма в спорте высших достижений. Представлены результаты исследований, полученных на базе Республиканского центра спортивной медицины. Подчеркнута необходимость стандартизации процедуры обследования.
Ключевые слова: вариабельность сердечного ритма, спортсмены, «Омега-С».
HEART RATE VARIABILITY IN SPORTSMEN Yu. Ae. Pitkevich
Republican Centre оf Sport Medicine, Minsk Belarusian Medical Academy оf Postgraduate Education, Minsk
The fundamental modern directions of development and application of heart rate variability in elite sport have been shown. The results of the researches carried out in the Republican Centre of Sport Medicine have been presented. The necessity for the standardization of the examination procedure has been underlined.
Key words: neart rate variability, sportsmen, «Omega-S».
За последние пять десятилетий, прошедших от предложения использовать анализ вариабельности сердечного ритма (ВСР) в клинической, космической, экспериментальной медицине, интерес к данному методу не снижается, и оценка ВСР находит все более широкое развитие как в Республике Беларусь, в России, так и за рубежом. Метод ВСР основан на детекции QRS-комплексов, измерении временных интервалов между R-зубцами электрокардиограммы, построении динамических рядов кардиоинтервалов с последующим математическим анализом .
В соответствии с разработками, выводами и положениями отечественных исследователей (Советского Союза) анализ вариабельности сердечного ритма рассматривается в качестве
метода оценки состояния механизмов регуляции, в частности, общей активности регуляторных механизмов, нейрогуморальной регуляции деятельности сердца, соотношения активности симпатического и парасимпатического отделов вегетативной нервной системы .
Методологический базис ВСР основан на трех концепциях :
1. Колебания сердечного ритма можно рассматривать с позиций общего адаптационного синдрома, а систему кровообращения - как индикатор адаптивных реакций целостного организма.
Оценивать ВСР следует как результат взаимодействия многоконтурной, иерархически организованной многоуровневой системы управления физиологическими функциями, доминирующая